analiza
Co kryje się za krytyką Teorii Poliwagalnej?
Opracowanie krytyki Teorii Poliwagalnej autorstwa dr. n. med. Antonii Pfeiffer zostało przetłumaczone z języka niemieckiego za zgodą autorki.
Oryginalny tekst ukazał się na stronie niemieckiego partnera Polyvagal Institute USA Polyvagal Akademie oraz został opublikowany w książce: „Emotionale Erinnerung – Klopfen als Schlüssel für Lösungen” („Emocjonalne wspomnienia – opukiwanie jako klucz do rozwiązania”), Carl-Auer-Verlag, 2022
dr Antonia Pfeiffer
Lekarka i badaczka. Studiowała medycynę na Wyższej Szkole Medycznej w Hanowerze (MHH), gdzie obroniła doktorat na temat: „Regulacja emocji za pomocą technik opukiwania – badanie z wykorzystaniem fMRT”. Ukończyła również szkolenie z zakresu psychologii zorientowanej na proces i ucieleśnienie (PEP).
Od 2021 roku prowadzi własną praktykę lekarską, w której pracuje z metodami terapii zorientowanymi na ciało, przede wszystkim z podejściem PEP. Równolegle prowadzi działalność naukową w Instytucie Insula w Hanowerze, gdzie bada regulację emocji poprzez ciało, pamięć emocjonalną oraz neurobiologiczne podstawy działania zintegrowanych terapii traumy.
W 2022 roku nakładem wydawnictwa Carl-Auer ukazała się jej książka „Emotionale Erinnerungen – Klopfen als Schlüssel für Lösungen”. Kluczowym celem jej pracy jest przekładanie odkryć naukowych na język zrozumiały, żywy i pełen empatii – tak, by mogli z nich korzystać zarówno terapeuci, jak i sami pacjenci.
Wprowadzenie I, czyli krótka historia Teorii Poliwagalnej
W 1994 roku Stephen Porges zaprezentował światu Teorię Poliwagalną. Ponieważ na kolejnych stronach temat tej teorii zostanie szczegółowo omówiony, warto najpierw przyjrzeć się jej „genezie”. Pozwoli to znacznie lepiej zrozumieć jej istotę.
Stephen Porges prowadził w latach 70. i 80. badania nad zmiennością rytmu serca i częstością akcji serca płodów na oddziale położniczym. U noworodków, które przyszły na świat w trudnych warunkach, wielokrotnie obserwował charakterystyczny wzorzec fizjologiczny:
- Wraz z narastającym stresem porodowym zmniejszała się zmienność rytmu serca, co oznaczało, że rytmizujący wpływ nerwu błędnego na serce ulegał osłabieniu.
- Jeśli komplikacje utrzymywały się lub nasilały, w kolejnym etapie pod wpływem układu współczulnego przyspieszało tętno (tachykardia).
- Gdy zagrożenie nadal wzrastało, następował spadek częstości akcji serca – noworodki przechodziły w stan bradykardii zagrażającej życiu, skutkującej niedokrwieniem narządów.
Oznacza to, że fizjologia noworodków zmieniała się proporcjonalnie do poziomu zagrożenia – w sytuacji stresowej ich układ nerwowy przechodził w znany stan współczulny „walcz albo uciekaj”, a przy skrajnie wysokim zagrożeniu ciało wchodziło w immobilizację związaną z bradykardią (Reed i in., 1999).
Stephen Porges zadał sobie wówczas kluczowe pytanie: która część układu nerwowego odpowiada za tę bradykardię i stan immobilizacji? Odpowiedzi znalazł w wynikach badań swoich kolegów: gdy u ssaków farmakologicznie wyłączano nerw błędny, dochodziło zarówno do zablokowania spokojnego, zdrowego rytmu serca, jak i tego spowolnionego, występującego w stanie zagrożenia życia. Oznaczało to, że nerw błędny odpowiada u tych zwierząt za obie te funkcje – zarówno za łagodną regulację autonomicznego układu nerwowego w stanie spoczynku, jak i za reakcję znieruchomienia w sytuacji zagrożenia życia.
Z tego wynikło kolejne pytanie: jak to możliwe, że wpływ nerwu błędnego na serce może być pozytywnym wskaźnikiem zdrowia (w przypadku zmienności rytmu serca, HRV), a jednocześnie sygnałem patologii (w przypadku bradykardii)?
Stephen Porges doszedł do następującego wniosku: u ssaków nerw błędny ma dwie odrębne źródła. Oznacza to, że nasz układ nerwowy nie składa się z dwóch, lecz z trzech obwodów regulacyjnych. Poza starszą obszarem nerwu błędnego, biorącego udział m.in. w reakcji udawania martwego w obliczu zagrożenia życia, Porges zakłada istnienie młodszego obszaru nerwu błędnego, która bierze udział w regulacji fizjologicznej w bezpiecznych relacjach społecznych.
Szczegółowa analiza Teorii Poliwagalnej wykraczałaby w tym miejscu poza temat niniejszego rozdziału. Osobom zainteresowanym mogę polecić anglojęzyczny artykuł Stephena Porgesa z 2022 roku pt. „Polyvagal Theory: A Science of Safety” lub – po niemiecku – odpowiednie rozdziały dotyczące „mechanizmów działania technik opukiwania i Teorii Poliwagalnej” z mojej książki “Emotionale Erinnerung – Klopfen als Schlüssel für Lösungen! (Pamięć emocjonalna: Opukiwanie jako klucz do rozwiązań!)”. Niniejszy tekst jest przecież właśnie rozdziałem specjalnym tej publikacji.
Wprowadzenie II, czyli historia krytyki Teorii Poliwagalnej
Od 1994 roku Teoria Poliwagalna zyskała znacznie więcej uwagi, niż Stephen Porges mógłby sobie wyobrazić w najśmielszych marzeniach. Zakładał, że inni naukowcy podejdą do jego teorii krytycznie, że pozwolą jej wpływać na swoje badania i że wejdą z nią w rezonans. Tymczasem to przede wszystkim terapeuci pracujący z traumą oraz ich pacjentki i pacjenci jako pierwsi poczuli głębokie powiązanie z tą teorią. Wielu z nich po raz pierwszy poczuło się dostrzeżonych w swoich objawach – dysocjacji, wewnętrznego odrętwienia, emocjonalnego „zamrożenia” – objawach, których dotychczasowa teoria autonomicznego układu nerwowego w ogóle nie uwzględniała.
Do dziś (22.09.2024) Teoria Poliwagalna została według naukowej wyszukiwarki Google Scholar zacytowana w 58 767 publikacjach naukowych (Google Scholar, 2024), z czego około 30 000 bezpośrednio odnosi się do samej teorii. Można to interpretować jako dowód na to, że również środowisko naukowe intensywnie się z nią mierzy. Według bazy danych PubMed Stephen Porges opublikował od 1969 roku – samodzielnie lub z innymi autorami – łącznie 193 artykuły naukowe, natomiast Google Scholar wskazuje ponad 400 publikacji. W centrum tych prac znajduje się zasadnicze pytanie Teorii Poliwagalnej: dlaczego poczucie bezpieczeństwa, miłości i więzi społecznych ma tak fundamentalne znaczenie dla naszego zdrowia – zarówno emocjonalnego, jak i fizycznego – oraz dla spójności społecznej?
Jednocześnie od lat niewielka grupa naukowców krytykuje neurobiologiczne założenia tej teorii – i czyni to w sposób skuteczny medialnie. Na przykład w Wikipedii Teoria Poliwagalna określana jest jako „w dużej mierze obalona” („Polyvagal-Theorie”, 2024). Próby złagodzenia tej polaryzującej i kategorycznej narracji były wielokrotnie blokowane lub bardzo szybko cofane. Aby lepiej zrozumieć rozbieżność pomiędzy publiczną oceną a faktycznym oddźwiękiem i praktycznym zastosowaniem teorii w nurcie terapii traumy zorientowanej na ciało, zanim przejdziemy do pogłębionej analizy samej teorii, przedstawiamy przegląd kluczowych punktów krytyki Teorii Poliwagalnej.
Krytyka Teorii Poliwagalnej
Analizowanie naukowej krytyki to z perspektywy socjologii wiedzy zawsze fascynujące zadanie, ponieważ – jak w prawdziwym życiu – także ta pozornie obiektywna krytyka bywa często nacechowana emocjonalnie lub ideologicznie. Dlatego obok analizy merytorycznej warto również przyjrzeć się samemu tonowi tej krytyki.Zacznijmy od tej drugiej kwestii: uderza przede wszystkim różnica w podejściu autorów. Na przykład hamburski osteopata Thorsten Liem i profesor anatomii z Erlangen, Winfried Neuhuber, piszą rzeczowe, dobrze uargumentowane i w gruncie rzeczy pełne szacunku teksty. Z kolei szwajcarski naukowiec z Bazylei, Paul Grossman, posługuje się językiem tendencyjnym, niemal wrogim. Na swoim blogu pisze na przykład: „Teoria Poliwagalna jest martwa” albo w publikacjach naukowych określa ją mianem „poliwagalnego zbioru hipotez” czy „poliwagalnych przypuszczeń” (Grossman 2023, s. 2–5, tłum. AP). Takie sformułowania skłaniają do refleksji, ponieważ już samo pojęcie teorii implikuje, że Stephen Porges nie przedstawił światu „prawdy poliwagalnej”, lecz teorię, która stale się rozwija i integruje nowe dane. On sam ujął to w pierwszym artykule z 1995 roku następująco: „Teoria Poliwagalna opiera się na kilku przesłankach. Niektóre są mocno zakotwiczone w danych neurofizjologicznych i neuroanatomicznych, inne mają raczej charakter spekulatywny” (Porges, 1995, s. 305–306, tłum. AP).
Przejdźmy teraz do trzech najważniejszych punktów merytorycznej krytyki. W centrum zarzutów znajdują się:
- pytanie, czy to rzeczywiście grzbietowe jądro nerwu błędnego wywołuje immobilizację („zamrożenie”) i bradykardię w sytuacjach zagrożenia życia;
- wątpliwość, czy mielinizowane, brzuszne włókna nerwu błędnego występują wyłącznie u ssaków;
- oraz kwestionowanie tego, czy zmienność rytmu serca (HRV) rzeczywiście odzwierciedla ogólnoustrojowy „stan wagalny”.
Przyjrzyjmy się tym punktom po kolei.
Aby zrozumieć, czy grzbietowy część nerwu błędnego jest zdolna do wywołania znaczącej bradykardii, należy znać pewne fakty anatomiczne: około 80% włókien nerwu błędnego prowadzących do serca u ssaków pochodzi z brzusznego jądra nerwu błędnego (nucleus ambiguus). Włókna te są mielinizowane, co oznacza, że są otoczone osłonką tłuszczową i przewodzą impulsy bardzo szybko. Pozostałe 20% wywodzi się z grzbietowego jądra nerwu błędnego, są to włókna niemielinizowane, przewodzące znacznie wolniej.
Nie ulega wątpliwości, że brzuszne jądro i mielinizowane włókna silnie wpływają na częstotliwość rytmu serca – u ludzi regulują one codziennie zwalnianie tętna podczas wydechu. Gdy jesteśmy zdrowi i nie nadmiernie zestresowani, brzuszne mielinizowane włókna nerwu błędnego działają jak „hamulec” dla pobudzającego wpływu układu współczulnego na serce. W efekcie serce bije wolniej przy wydechu niż przy wdechu. Zjawisko to znane jest jako arytmia zatokowa oddechowa (respiratory sinus arrhythmia) i stanowi zdrową zmienność rytmu serca (HRV).
Wpływ grzbietowego jądra nerwu błędnego na rytm serca pozostaje natomiast przedmiotem sporów od dawna. Neutralni naukowcy niezwiązani bezpośrednio ze sporem wokół Teorii Poliwagalnej twierdzą, że grzbietowe włókna pełnią funkcjonalnie istotną rolę w unerwieniu serca (Veerakumar i in., 2022), chroniąc je na przykład w warunkach niedotlenienia. Z drugiej strony również oni podnoszą kwestię, czy jądro grzbietowe wpływa na częstość akcji serca, jako „historyczną kontrowersję”, która do dziś nie została ostatecznie wyjaśniona (Strain i in., 2024, s. 9, tłum. AP).
Istnieją badania na zwierzętach, które wspierają oba stanowiska w tej debacie. Z jednej strony są takie, które przy stymulacji grzbietowego jądra nerwu błędnego wykazują niewielką lub wręcz żadną bradykardię. Właśnie te badania skłoniły wielu krytyków do ostatecznego wniosku, że grzbietowa część nerwu błędnego nie jest w stanie wywołać istotnej bradykardii (Grossman, 2023; Liem, Thorsten & Neuhuber, Winfried, 2021; Neuhuber & Berthoud, 2022). Czytając te publikacje, można rzeczywiście zrozumieć perspektywę krytyków. Wydaje się możliwe, że to nucleus ambiguus (czyli brzuszne jądro) odpowiada zarówno za regulującą bradykardię związaną z HRV, jak i za bradykardię w sytuacji zagrożenia życia.
Dopiero dwa lata temu wykazano istnienie dwóch różnych podgrup neuronów w jądrze dwuznacznym (czyli brzusznym jądrze nerwu błędnego) w pniu mózgu: jedna z tych grup działa wyłącznie na serce — pośredniczy w barorefleksie, czyli spadku częstości akcji serca w odpowiedzi na podwyższone ciśnienie krwi. Autorzy zakładają, że ten obwód neuronalny pośredniczy również w występowaniu arytmii oddechowej zatokowej. Druga grupa neuronów oddziałuje zarówno na serce, jak i płuca, i uczestniczy w tzw. odruchu nurkowania – czyli jednoczesnym zwolnieniu akcji serca i skurczu oskrzeli podczas zanurzenia w zimnej wodzie. Badacze zakładają, że ta druga grupa neuronów – ta biorąca udział w odruchu nurkowania – wykształciła się w toku ewolucji dopiero po przejściu organizmów ze środowiska wodnego na ląd. W czasach, gdy zwierzęta poruszały się między morzem a lądem, odruch ten był z pewnością „szczególnie cenny” (Veerakumar i in., 2022, tłum. AP, s. 8).
W cytowanym badaniu wspomina się więc również o dwóch obwodach neuronalnych, które powstały na różnych etapach ewolucji. Można by więc łatwo powiedzieć: okej, być może to ten drugi obwód odpowiada po prostu za reakcje, które Stephen Porges opisał jako charakterystyczne dla sytuacji skrajnego zagrożenia życia.
Ale w nauce rzadko coś bywa takie proste. Badania, które sprawdzają, co się dzieje, gdy odruch nurkowania zostaje uruchomiony w warunkach odczuwanego zagrożenia życia, sugerują, że obwody odpowiadające za odruch nurkowania i za bradykardię w sytuacji zagrożenia życia są od siebie różne. Nie wiadomo jednak, czy różnice dotyczą jedynie obwodów aferentnych (czyli prowadzących sygnały do mózgu), czy także eferentnych (czyli biegnących z mózgu do serca).
Poniższe eksperymenty nie rozwiązują tego problemu, ale są na tyle interesujące, że i tak chciałabym je przedstawić. W ich trakcie zanurzano pod wodę szczury lub myszy laboratoryjne. Zwierzęta dobrze to znosiły, a częstość akcji serca nieznacznie spadała – był to wspomniany wcześniej odruch nurkowy, pośredniczony przez nerw błędny. Jednak gdy przed zanurzeniem wprowadzano zwierzęta w stan silnego lęku, duży odsetek z nich umierał z powodu zatrzymania akcji serca. W warunkach jednoczesnego strachu i zanurzenia dochodziło do skrajnych bradykardii – tętno spadało nawet do sześciu uderzeń na minutę. Tego nie da się wytłumaczyć zwykłym odruchem nurkowym. W jednym z badań odruch ten obniżał częstość akcji serca z 300 do 280 uderzeń na minutę; obecność dodatkowego zagrożenia powodowała spadek do 30 uderzeń na minutę. U tych zwierząt (z jednoczesną indukcją strachu) opisywano też oznaki immobilizacji, jak charakterystyczne zwiotczenie mięśni. Nie występowało ono, gdy zwierzęta były zanurzane w stanie spokoju.
Poniższe zdania pochodzą z jednego z oryginalnych artykułów:
„W eksperymencie przeprowadzonym kilka lat temu Richter umieścił dzikie szczury, które potrafią pływać praktycznie bez ograniczeń, w cylindrze wypełnionym wodą, zamkniętym od góry ruchomą pokrywą, uniemożliwiającą ucieczkę. U szczurów zaobserwowano stopniowy spadek częstości akcji serca, z powtarzającymi się pauzami aż do ostatecznego zatrzymania serca. Wstępne podanie atropiny lub chlopraminy [czyli blokada nerwu błędnego] wydłużało czas przeżycia. Podczas autopsji nie stwierdzono oznak utonięcia (tzw. „suche płuca”). Richter przypisał te nagłe zgony nadaktywności nerwu błędnego, wywołanej czynnikami psychologicznymi – zwłaszcza poczuciem beznadziei – kiedy zwierzęta uświadomiły sobie, że nie mają możliwości ucieczki. Aby poprzeć tę hipotezę, Richter opisał, że szczury nie umierały, gdy wcześniej usunięto poczucie beznadziei. Osiągnięto to, zanurzając je kilkakrotnie na krótko w cylindrze i następnie wypuszczając. W ten sposób szczury szybko nauczyły się, że sytuacja nie jest naprawdę bez wyjścia – stawały się agresywne, nie godziły się z losem i nie wykazywały oznak poddania się.”
(Alboni i in., 2011, s. 3, tłum. AP)
Warto dodać, że również u ludzi w 10–15% przypadków zgonów zakwalifikowanych jako utonięcie nie stwierdza się obecności wody w płucach. Także w tych przypadkach podejrzewa się, że przyczyną śmierci była ekstremalna bradykardia. Autorzy cytowanego badania uważają, że może ona wynikać z jednoczesnej aktywacji odruchu nurkowego i bradykardii wywołanej strachem (Alboni i in., 2011).
Interesujące jest więc pytanie, który obszar mózgu odpowiada za tę bradykardię. Trudno jednak eksperymentalnie wykazać, który konkretnie ośrodek wywołuje bradykardię i immobilizację w sytuacji zagrożenia życia, jeśli badania nie odwzorowują takich realnych warunków. Sama miałam trudności ze znalezieniem prac, które dotyczyłyby aktywności neuronalnej właśnie przy takiej bradykardii, jaka interesuje Stephena Porgesa – tej pojawiającej się przy realnym zagrożeniu życia. Szukanie takich badań w dostępnych bazach przypominało dosłownie szukanie igły w stogu siana.
Jedno z takich badań pokazało jednak, że u noworodków szczurów znajdujących się w stanie zagrożenia życia, przy silnej bradykardii i duszności, rzeczywiście dochodziło do wzmożonej aktywacji grzbietowego jądra nerwu błędnego (Baldy i in., 2017). Również w badaniach nad nagłą śmiercią niemowląt rozważa się, czy przyczyną nie jest nieprawidłowa aktywacja tego jądra przy niedotlenieniu, która prowadzi do zahamowania pracy serca i oddychania (Bejjani i in., 2013).
Wróćmy teraz do grzbietowego jądra nerwu błędnego i możliwości, że to ono wywołuje bradykardię w sytuacji zagrożenia życia. Istnieją również badania, które dokładnie to pokazują – opisują one istotną bradykardię wywołaną stymulacją grzbietowego jądra lub włókien grzbietowych nerwu błędnego.
W jednym z badań na myszach z 2024 roku wykazano znaczącą bradykardię po stymulacji grzbietowego jądra nerwu błędnego. W eksperymencie zastosowano dwie nowoczesne technologie do jego stymulacji – i w obu przypadkach wywołano wyraźną bradykardię: częstość akcji serca spadła o odpowiednio 56% i 65% (Strain i in., 2024). Autorzy tej pracy sugerują, że w innych badaniach mogło dochodzić do stymulacji hamujących włókien nerwowych w obrębie jądra grzbietowego – takich, które blokują właśnie te włókna, które normalnie mogłyby wywołać bradykardię (Uwaga: to zdanie warto przeczytać dwa razy!).
Dodatkową, choć drobną wskazówką, że grzbietowe jądro nerwu błędnego może uczestniczyć w reakcji immobilizacji połączonej z bradykardią, są badania, w których u zwierząt zaobserwowano defekację pod wpływem stresu w stanie tzw. alarmowej bradykardii – co może mieć związek z tym, że grzbietowe jądro nerwu błędnego unerwia głównie narządy znajdujące się poniżej przepony (Alboni & Alboni, 2017).
W innym badaniu bezpośrednio stymulowano włókna grzbietowe (niezmielinizowane), brzuszne (zmielinizowane), a następnie oba naraz, bezpośrednio w nerwie błędnym. Stymulacja każdej z tych grup osobno powodowała spadek tętna o 24 uderzenia na minutę, natomiast wspólna stymulacja obu typów włókien prowadziła do silniejszej i dłużej utrzymującej się bradykardii – tętno spadało o 39 uderzeń na minutę (Woolley i in., 1987).
Także w kolejnym badaniu wspólna stymulacja doprowadziła do bardziej wyraźnej (tętno: 169) i dłużej trwającej bradykardii niż stymulacja samych włókien zmielinizowanych (tętno: 182) (Ford & McWilliam, 1986). Dodatkowe badania z tego okresu również wykazywały bradykardię przy stymulacji niezmielinizowanych włókien, która była co prawda słabsza, ale utrzymywała się dłużej niż ta wywołana przez włókna zmielinizowane (przegląd tych badań znajduje się w: Garcia Perez & Jordan, 2001).
W swoim „pierwszym artykule” na temat Teorii Poliwagalnej z 1995 roku Stephen Porges przedstawił dane z eksperymentów na królikach, w których porównywano stymulację nervus aorticus depressor (obszar nerwu błędnego, przekazująca informacje aferentne do jądra samotnego – NTS – i hipotetycznie do obu jąder nerwu błędnego) z bezpośrednią stymulacją grzbietowego jądra nerwu błędnego (DVM).
Także kolejne badania dostarczają dowodów na to, że stymulacja grzbietowego jądra może wywołać bradykardię. W jednym z badań z 2021 roku analizowano wpływ cząsteczki o nazwie saluzyna-beta na ciśnienie krwi i częstość akcji serca. Wykazano, że obie wartości spadały, jeśli substancję podano bezpośrednio do grzbietowego jądra nerwu błędnego – ale nie w przypadku podania do innych obszarów (Wu i in., 2021).
Dwa inne badania analizujące działanie oksytocyny na grzbietowe jądro nerwu błędnego również wykazały spadek tętna po jej wstrzyknięciu – ale tylko wtedy, gdy nerw błędny był nienaruszony (czyli nie zablokowany farmakologicznie). Choć badania te nie dotyczą immobilizacji w sytuacji zagrożenia życia, to odnoszą się do tzw. „stanu mieszanego” – immobilizacji bez strachu – w którym oksytocyna odgrywa ważną rolę (Higa i in., 2002; Rogers & Hermann, 1985).
Zastanawiam się, jak to możliwe, że krytyk Grossman w swoich badaniach do artykułu z 2023 roku przeoczył te wszystkie prace. Pisze tam bowiem: „W żadnym badaniu nigdy nie opisano głębokiego spowolnienia rytmu serca wywołanego przez DVMN” (czyli grzbietowe jądro nerwu błędnego); (Grossman, 2023, s. 2).
Ogólny obraz, jaki wyłania się z lektury dostępnych badań, jest taki, że wciąż brakuje wystarczająco licznych, wysokiej jakości prac, które pozwoliłyby jednoznacznie rozstrzygnąć tę kwestię. Różnorodność wyników nie sprzyja jeszcze formułowaniu ostatecznych wniosków.
W trakcie wielu miesięcy porównywania tych badań miałam wrażenie, że prawda leży prawdopodobnie gdzieś pośrodku – i jeszcze nie została w pełni odkryta. Być może to właśnie wspólna aktywacja włókien grzbietowych i brzusznych prowadzi do „ekstremalnej” bradykardii, tak jak pokazują to badania na królikach. A jeśli ostatecznie okaże się, że w bradykardii w sytuacjach zagrożenia życia bierze udział ewolucyjnie starsza część nucleus ambiguus, to przecież nie trzeba od razu przekształcać całej Teorii Poliwagalnej – może wystarczy zmienić jej nazewnictwo.
Stephen Porges sam zresztą nie wyklucza udziału włókien brzusznych w bradykardii występującej w sytuacjach zagrożenia życia. Co więcej, uważa za możliwe, że „mechanizmy grzbietowo-wagalne […] mogą wywoływać kompensacyjną bradykardię poprzez szlaki brzuszno-wagalne” (Porges, 2023, s. 6).
Ciekawe jest, że to właśnie jednoczesna stymulacja włókien grzbietowych i brzusznych w cytowanych wcześniej badaniach na królikach prowadziła do najsilniejszej i najdłużej trwającej bradykardii – tej, która najbardziej przypomina bradykardię związaną z immobilizacją w stanie zagrożenia życia.
Dodatkowo Porges opisuje w “Paradoks wagalny”, jak wpływ błędno-grzbietowy – poprzez obniżenie kurczliwości serca i ciśnienia krwi – może prowadzić do odruchowej i adaptacyjnej bradykardii (Porges, 2023).
Być może potrzeba jeszcze kilku lat, zanim dzięki nowym technologiom uda się precyzyjnie prześledzić działanie włókien brzusznych i grzbietowych nerwu błędnego w kontekście bradykardii pojawiającej się w obliczu realnego zagrożenia życia. Dotyczy to również pytania, które z jąder bierze udział w reakcji freeze (zamrożenia).
Założenia krytyków Porgesa, że reakcja freezing jest wywoływana przez obszar mózgu zwany PAG (istota szara okołowodociągowa), aktywowany przez ciało migdałowate i działający poprzez aktywację nerwu błędnego – są zgodne ze standardowymi podręcznikami neurobiologii. Jednak także Stephen Porges, w swoich publikacjach, opisuje ten szlak jako możliwą drogę prowadzącą do bradykardii i immobilizacji w sytuacji zagrożenia życia.
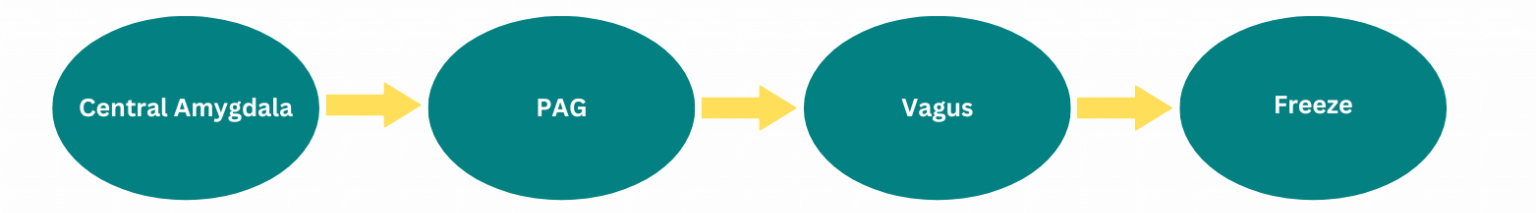
Nie udało mi się znaleźć żadnych wypowiedzi Stephena Porgesa, które wyrażałyby przeciwny pogląd. Pytanie, które pozostaje otwarte i bardzo ciekawe, brzmi: czy opisywany mechanizm uruchamiany jest przez jądro brzuszne, czy grzbietowe? W literaturze można znaleźć artykuły popierające jedno i drugie stanowisko – ale nie istnieje jednoznaczna, powszechnie uznana interpretacja (Roelofs, 2017). Istota szara okołowodociągowa (PAG) wydaje się mieć połączenia z obydwoma jądrami (Maniyar i in., 2014). Problem w tym, że również w tym przypadku dostępnych jest bardzo niewiele badań, które mogłyby te założenia potwierdzić lub im zaprzeczyć. To samo dotyczy kolejnego punktu krytyki.
Drugim istotnym zarzutem ze strony krytyków jest to, że niektóre współczesne ryby, gady i ptaki również posiadają obszar brzuszny nerwu błędnego, z którego wychodzą zmielinizowane włókna mające wpływ na rytm serca – podobnie jak u ssaków (Liem, Thorsten & Neuhuber, Winfried, 2021; Grossman, 2023; Taylor i in., 2022).
Stephen Porges odpowiada, że nie można obalać tego założenia Teorii Poliwagalnej na podstawie współczesnych badań anatomicznych dotyczących żyjących dziś gatunków. Jak pisze: „Ssaki nie wyewoluowały ze współczesnych gadów” (Porges, 2023, s. 4; tłum. A.P.). Porges wskazuje, że dzisiejsze gady i dzisiejsze ssaki wywodzą się ze wspólnego, wymarłego przodka – tzw. „pra-gada”. Badania nad współczesnymi gadami miałyby sens jedynie wtedy, „gdyby gatunki analizowane przez anatomów porównawczych od momentu ich pierwszego pojawienia się w ewolucji w ogóle się nie zmieniły” (Porges, 2023, s. 4; tłum. A.P.).
Do zrozumienia tej kwestii przydatna może być także następująca informacja: uważa się, że jądro grzbietowe i jego niezmielinizowane włókna są ewolucyjnie starsze niż jądro brzuszne z jego zmielinizowanymi włóknami. Także u embrionów jądro grzbietowe oraz jego połączenia z sercem rozwijają się wcześniej niż brzuszne. Włókna brzuszne pojawiają się dopiero później. Rozwój jądra grzbietowego jest u noworodka funkcjonalnie prawie zakończony, natomiast rozwój obszaru brzuszno-wagalnego i mielinizacja jego włókien trwa aż do końca pierwszego roku życia (Becker i in., 1993; Cerritelli i in., 2021; Cheng i in., 2008; Pereyra i in., 1992; Strain i in., 2024).
Aby rozważyć różnice między układem nerwowym gadów i ssaków z jeszcze innej perspektywy, warto postawić sobie także inne, naprawdę fascynujące pytania: Czy życie społeczne gadów i ssaków wygląda tak samo? Czy gady w takim samym stopniu jak ssaki potrzebują kontaktu społecznego i komunikacji w rozwoju? A jako badaczka, która przez lata zajmowała się „emocjonalną” funkcją skóry, dodam jeszcze jedno pytanie: Jaką rolę odgrywa dotyk w codziennym życiu i regulacji układu nerwowego gadów – a jaką u ssaków?
Choć przy bliższym przyjrzeniu się gady okazują się bardziej społeczne, niż długo sądzono (istnieje na ten temat cała książka, której niestety jeszcze nie czytałam, ale same recenzje i tytuł są obiecujące: The Secret Social Lives of Reptiles, Doody, S., J. i in., 2021), badania pokazują, jak bardzo sposób życia społecznego gadów różni się od tego, jaki obserwujemy u ssaków.
W jednym z eksperymentów jaszczurki wychowywane w izolacji osiągały większe rozmiary i były dłuższe – a także wykazywały oznaki większej zdolności do przeżycia (np. zachowywały ogony) w porównaniu do tych, które dorastały w towarzystwie innych jaszczurek (Riley i in., 2017).
U ssaków jest odwrotnie – ich rozwój jest poważnie zaburzony, jeśli dorastają w izolacji, co pokazują następujące przykłady: w latach 60. badacz Harry Harlow i jego zespół prowadzili eksperymenty z izolacją małp, po tym jak w ich laboratorium pojawiły się przypadki gruźlicy i starano się zapobiec zakażeniom. Małpy wychowywane bez kontaktu społecznego zaczęły przejawiać zachowania przypominające objawy zaburzeń psychicznych u ludzi: kołysały się, wpatrywały się w pustkę, nerwowo krążyły po klatkach i raniły same siebie. Gdy ponownie wprowadzono je do grupy, nie potrafiły się w niej odnaleźć – niektóre z nich odmawiały jedzenia i z tego powodu umierały. Samice wychowane w izolacji raniły swoje młode.
Również inne ssaki reagują na izolację stresem – w niedawno opublikowanym badaniu myszy w średnim wieku, poddane izolacji przez zaledwie trzy tygodnie, zaczęły wykazywać objawy depresji (Magalhães i in., 2024).
Również w znaczeniu dotyku dla dobrostanu widać wyraźne różnice między gadami a ssakami. Wyszukiwanie w bazie PubMed hasła „społeczny dotyk gady” nie daje żadnych wyników, podczas gdy zapytanie „społeczny dotyk ssaki” zwraca 3655 rezultatów. Przez „społeczny dotyk” rozumie się tutaj wszelkie formy kontaktu dotykowego, które ssaki stosują na co dzień: przytulanie, muskanie, lizanie, głaskanie. Mają one kluczowe znaczenie dla fizjologicznej regulacji u ssaków.
Za ten efekt odpowiadają receptory znajdujące się w owłosionej skórze ssaków, które przekazują informacje o delikatnym, pieszczotliwym dotyku do „emocjonalnych” obszarów mózgu. Te małe receptory (CT-aferenty – cały rozdział w mojej książce jest im poświęcony!) i włókna nerwowe nie przekazują precyzyjnej informacji zmysłowej. Zamiast tego ich aktywacja wpływa regulująco na układ nerwowy. Można powiedzieć, że przesyłają one czyste sygnały życzliwości i więzi – i tylko wtedy, gdy osoba dotykająca oraz sam dotyk są postrzegane jako bezpieczne i przyjemne.
W ten sposób sygnały płynące przez skórę mogą działać jako sygnały bezpieczeństwa, które za pośrednictwem tylnej części wyspy (insula posterior) wpływają na regulację ciała migdałowatego w sytuacjach stresu (Kong i in., 2014). Już kilka miesięcy po narodzinach niemowlęta reagują na tego typu delikatny, pieszczotliwy dotyk regulacją swojego układu nerwowego – co ma zasadnicze znaczenie dla ich prawidłowego rozwoju. Z tego względu zjawisko to powinno być uwzględnione w dyskusji o Teorii Poliwagalnej – i przemawia za tym, że znaczenie społecznej interakcji dla dobrostanu ssaków i gadów różni się zasadniczo (Croy i in., 2022).
A teraz wróćmy z powrotem do krytyki Teorii Poliwagalnej. Fascynujące jest to, że krytyka skupia się niemal wyłącznie na neurobiologicznych założeniach teorii – tych samych, które Stephen Porges sam nie uznaje za jej główne przesłanie. Za centralną ideę swojej pracy Porges uznaje znaczenie poczucia bezpieczeństwa dla naszego emocjonalnego i fizycznego dobrostanu. Ujmuje to w następujący sposób:
„Gdy człowiek czuje się bezpieczny, jego układ nerwowy wspiera homeostatyczne funkcje zdrowia, wzrostu i regeneracji, a jednocześnie pozwala mu być dostępnym dla innych, bez odczuwania lub okazywania zagrożenia i podatności na zranienie.”
(Porges, 2022, s. 2)
Jeśli uważnie czytamy jego najnowsze teksty, staje się jasne, co tak naprawdę chce on przekazać światu swoją pracą. I szkoda, że ten przekaz często ginie w krytycznych dyskusjach. Chodzi mu bowiem o przełożenie uzdrawiającej mocy relacji i miłości na język fizjologii. Jego intencją jest wyjaśnienie emocjonalnego i fizjologicznego znaczenia bezpieczeństwa – i pokazanie, w jaki sposób poprzez ciało i relacje możemy odbierać sygnały bezpieczeństwa, a tym samym wzmacniać nasze zdrowie i zdolność do nawiązywania więzi. To przesłanie mogłoby być jednym z tych, które naprawdę pomagają zmieniać świat.
Ale wróćmy ponownie do krytyki. Krytycy zarzucają Porgesowi, że przypisuje “kompleksowi błędnemu brzysznemu” funkcje, których sam nerw błędny nie pełni – jak np. aktywację mięśni twarzy. Uważają, że zamiast mówić o „kompleksie wagalnym”, powinien używać określenia „region nerwów czaszkowych”. Jednak właśnie to – układ nerwów czaszkowych – ma Porges na myśli, gdy mówi o kompleksie błędnym brzusznym. Termin ten stosuje on zamiennie z pojęciem „systemu zaangażowania społecznego” (Porges, 1995, 2023).
Kolejny istotny punkt krytyki dotyczy zmienności rytmu serca (HRV). Krytycy kwestionują, czy na podstawie HRV można wnioskować o stanie innych narządów niż samo serce (Neuhuber & Berthoud, 2022). Grossman natomiast poddaje w wątpliwość, na ile zmienność rytmu serca (HRV) w ogóle koreluje z procesami emocjonalnymi (Grossman, 2023).
Co ciekawe, sam Porges opowiada się za bardzo precyzyjnym zdefiniowaniem poszczególnych obwodów nerwowych. Kiedy czytał niniejszy tekst, napisał mi, że Teoria Poliwagalna nie utożsamia tonu nerwu błędnego z HRV. Oznacza to, że na podstawie HRV nie możemy wnioskować bezpośrednio o funkcjonowaniu nerwu błędnego w różnych narządach, choć istnieją przesłanki, że HRV niesie informacje o stanie zdrowia rozmaitych układów. Dla klinicystów kluczowe jest pytanie, czy HRV rzeczywiście zmienia się pod wpływem stresu fizycznego i psychicznego? Dlatego zamierzam poświęcić temu zagadnieniu osobny akapit.
Zawsze przypomina mi się tu rozmowa przy kawie z moim dawnym szefem, prof. Florianem Beißnerem, który jako neurobiolog długo pracował nad technikami obrazowania jąder nerwu błędnego w fMRT i zajmował się HRV na najwyższym, naukowym poziomie. Opowiadał wtedy, jak trudne jest prawidłowe wyznaczanie i interpretowanie zmienności rytmu serca. Poniższe badania dostarczają więc tylko wskazówek, jak HRV zmienia się przy chorobach różnych układów:
- Niskie HRV pojawia się w wielu schorzeniach somatycznych: u pacjentów z zapaleniem i/lub sepsą (Adam i in., 2023), z infekcjami po udarze (Brämer i in., 2019), chorobą Parkinsona (Li i in., 2021), padaczką (Lotufo i in., 2012), przy bólu i zapaleniu w chorobie zwyrodnieniowej stawów (Sohn i in., 2024) czy w zespole Sjögrena (Lin i in., 2024). W wielu tych pracach HRV korelował z aktywnością choroby – zaostrzenia lub silniejsze objawy wiązały się z niższym HRV.
- Niskie HRV często łączy się też z procesami emocjonalnymi. Metaanaliza z 2023 r. obejmująca 15 badań dotyczących HRV i reakcji na stres wykazała, że „HRV jest wiarygodnym wskaźnikiem reakcji psychologicznego stresu” (Immanuel i in., 2023, s. 1). Inna metaanaliza – 31 badań z udziałem 4534 osób – potwierdziła związek między HRV a nasileniem depresji zarówno u dzieci, jak i dorosłych (Ding i in., 2024). Dalsze prace wskazują na obniżone HRV u pacjentów z zaburzeniami lękowymi, schizofrenią, osobowością borderline oraz PTSD (Visted i in., 2017).
Co dla nas, klinicystów, szczególnie fascynujące: objawy tych właśnie chorób – tak somatycznych, jak i psychicznych – można często znacząco złagodzić dzięki elektrycznej stymulacji nerwu błędnego.
Elektryczna Stymulacja Nerwu Błędnego przy chorobach przewlekłych
Elektryczna stymulacja nerwu błędnego jest obecnie badana jako metoda leczenia wielu przewlekłych chorób. Lewy nerw błędny stymulowany jest przy tym bezpośrednio przez implant umieszczony pod skórą lub – w nowszych badaniach – przez formy stymulacji, w których nerw błędny stymulowany jest przez skórę na szyi lub uchu.
Ogólnie rzecz biorąc, badania dają zachęcające wskazówki, że objawy bardzo różnych jednostkach chorobowych mogą być zaskakująco złagodzone przez stymulację nerwu błędnego. W przypadku niektórych chorób stymulacja nerwu błędnego jest oficjalnie dopuszczona jako opcja leczenia. Stymulacja nerwu błędnego została zatwierdzona jako leczenie padaczki opornej na terapię w 1997 roku.
Badania pokazują, że ponad 60% pacjentów doświadcza co najmniej 50-procentowej redukcji objawów (Bauer i in., 2016; Elliott, Morsi, Kalhorn i in., 2011; Elliott, Morsi, Tanweer i in., 2011). Ponadto pacjenci odczuwają znaczną poprawę jakości życia, przejawiającą się lepszą czujnością (58–63%), poprawą nastroju (43–49%), komunikacji werbalnej (38–45%), wyników w nauce (29–39%) oraz pamięci (29–38%) (Englot i in., 2017). Od 2005 roku stymulacja nerwu błędnego jest dopuszczona jako metoda leczenia depresji opornej na leczenie farmakologiczne. Badania długoterminowe wskazują na redukcję objawów o co najmniej 50% u nawet 67% pacjentów, przy czym u maksymalnie 43% osiągnięto remisję (Aaronson i in., 2017).
W ciągu ostatnich 10 lat coraz więcej badań koncentrowało się także na chorobach somatycznych. Choć dostępne badania mają niewielką liczebność próby, ich wyniki są imponujące. W niewielkim badaniu z 2020 roku wszczepiono dziewięciu pacjentom z przewlekłą zapalną chorobą jelit urządzenie do elektrycznej stymulacji nerwu błędnego. Po roku ból zmniejszył się o 51%, znany marker stanu zapalnego (CRP) spadł o 60%, a wskaźnik aktywności choroby obniżył się o 67%; u 70% pacjentów stwierdzono remisję (Sinniger i in., 2020).
W badaniu z 2016 roku osiemnastu pacjentom, u których nie zadziałały nawet najsilniejsze leki przeciwreumatyczne, wszczepiono stymulator nerwu błędnego. W 42. dniu badania aktywność choroby zmniejszyła się u 70% pacjentów o 20%, a u 57% o 50% (Koopman i in., 2016).
Kolejne badania wykazują poprawę objawów klinicznych, zmniejszenie zmęczenia (fatigue) oraz zmianę markerów immunologicznych we krwi u pacjentów z chorobami autoimmunologicznymi, takimi jak toczeń rumieniowaty układowy czy zespół Sjögrena. Przykładowo, doświadczana intensywność bólu zmniejszyła się u 83,3% pacjentów poddanych rzeczywistej stymulacji nerwu błędnego, podczas gdy w grupie z pozorowaną stymulacją istotną redukcję bólu odnotowano jedynie u 16,7%. W przypadku ocenianych przez lekarzy obrzękniętych, bolesnych stawów, poprawę stwierdzono u 100% pacjentów, którzy otrzymali prawdziwą stymulację. Prawdopodobieństwo istotnego zmniejszenia objawów zespołu przewlekłego zmęczenia było 54,6 razy wyższe w grupie rzeczywistej stymulacji niż w grupie placebo (Aranow i in., 2021).
Pozostaje fascynujące pytanie, czy te obiecujące wyniki potwierdzą się w badaniach z większą grupą uczestników — oraz czy podobne efekty będzie można uzyskać również za pomocą metod nieelektrycznej stymulacji.
Na koniec przejdźmy do jednego z zarzutów, który mniej lub bardziej subtelnie przewija się w niektórych krytycznych głosach: mianowicie do krytyki, że teoria poliwagalna jest wykorzystywana przez terapeutów pracujących z ciałem jako model wyjaśniający ich interwencje terapeutyczne — i tylko z tego powodu zyskuje na popularności (Walz & Grossman, 2024). Dlatego ostatni rozdział poświęcony będzie pytaniu: Czy stymulacja nerwu błędnego w konfrontacji z trudnymi bodźcami może wpłynąć na skuteczność terapii i stanowić dodatkową korzyść terapeutyczną?
To nie jest temat bez znaczenia, ponieważ terapie konfrontacyjne w nurcie behawioralnym napotykają na poważne ograniczenia, szczególnie w przypadku silnych lęków i traum. Ekspozycja na bodźce traumatyczne lub silnie lękowe może prowadzić u pacjentów do bardzo wysokiego pobudzenia (arousal). W artykule z 2015 roku tylko 46,8% spośród 684 ankietowanych terapeutów poznawczo-behawioralnych stosowało w ogóle terapie konfrontacyjne, takie jak ekspozycja. Podano następujące powody: około 70% respondentów wskazywało, że zarządzanie czasem podczas terapii konfrontacyjnej jest trudne do przewidzenia ze względu na silne pobudzenie pacjentów; u 66% skutkowało to odwołaniem kolejnych sesji. 52% terapeutów przyznało, że potrzebowaliby dodatkowych strategii do regulacji pobudzenia wywołanego przez terapię, a 23% obawiało się retraumatyzacji swoich pacjentów. 37% stwierdziło, że przeprowadzanie konfrontacji jest dla nich samych bardzo obciążające (Pittig i in., 2019). Jeden z autorów pisze, że „znaczna liczba pacjentów nie wykazuje istotnej redukcji objawów lub dochodzi u nich do nawrotu lęku” (Pittig i in., 2016, s. 403).
Poniższe badania dotyczące konfrontacji wspomaganej stymulacją nerwu błędnego dostarczają przesłanek, że taka interwencja może prowadzić do „bezpieczniejszej”, łagodniejszej i skuteczniejszej konfrontacji. Przyjrzyjmy się najpierw podstawom naukowym, analizując badania dotyczące elektrycznej stymulacji nerwu błędnego, a następnie przejdźmy do kilku badań poświęconych terapiom traumy zorientowanym na ciało. Osobom zainteresowanym tym, jak dokładnie stymulacja nerwu błędnego jest implementowana w tych terapiach, mogę zresztą polecić moją książkę — wyjaśnienie tego zagadnienia tutaj przekroczyłoby ramy tego rozdziału.
Najpierw kilka badań na zwierzętach: w jednym z eksperymentów szczury, które podczas konfrontacji z wywołującymi lęk bodźcami otrzymywały stymulację nerwu błędnego, potrzebowały pięć razy mniej sesji konfrontacyjnych, aby wygasić wyuczoną reakcję lękową. Efekt ten zaobserwowano również w przypadku nieco dłużej utrzymujących się lęków, które badacze pamięci uznają za bardziej utrwalone i odporne na wygaszanie.
To badanie, podobnie jak inne, wskazuje również na to, że stymulacja nerwu błędnego aktywuje przyśrodkową część kory przedczołowej (ventromedial prefrontal cortex) — obszar mózgu, który często ulega dezaktywacji w warunkach silnego stresu. To właśnie ta dezaktywacja może być jednym z powodów, dla których terapie konfrontacyjne często nie przynoszą oczekiwanych efektów u pacjentów z zespołem stresu pourazowego (PTSD) (Peña i in., 2014; Peña i in., 2013; Szeska i in., 2020, 2022).
Stymulacja nerwu błędnego podczas konfrontacji u młodych szczurów prowadziła również do rozszerzenia efektu wygaszania na inne, współwystępujące bodźce — także te, które nie były bezpośrednio poddane konfrontacji (Souza i in., 2021). Szczury wykazujące objawy zespołu stresu pourazowego (PTSD), takie jak lękliwość, zwiększona podatność na stres czy wycofanie społeczne, doświadczyły poprawy tych objawów dzięki konfrontacji wspomaganej stymulacją VNS — mimo że objawy te nie były bezpośrednio adresowane. Po interwencji zwierzęta ponownie wykazywały normalne zachowania społeczne — dokładnie tak, jak przewiduje teoria Porgesa (Noble i in., 2017).
U ludzi cierpiących na PTSD stymulacja nerwu błędnego, stosowana podczas głośnego czytania tekstu traumatycznego, prowadziła do spadku poziomu markerów stanu zapalnego we krwi, takich jak IL-6 i interferon-γ — podczas gdy w grupie kontrolnej, która nie otrzymała stymulacji, ich poziom wzrastał. Inne badania wskazują również na zmniejszenie poziomu markerów bólu i stresu u pacjentów poddawanych konfrontacji w trakcie odstawiania opioidów (Bremner i in., 2020; Gazi i in., 2022; Gurel i in., 2020; Wittbrodt i in., 2020).
Wszystkie te badania sugerują, że stymulacja układu przywspółczulnego, a konkretnie nerwu błędnego, może rzeczywiście przynosić korzyści w warunkach terapeutycznych. Jeśli przyjąć argumentację Porgesa, można przypuszczać, że terapie konfrontacyjne z wykorzystaniem stymulacji nerwu błędnego mogą być przez pacjentów postrzegane jako „bezpieczniejsze”.
Pierwsze badania nad terapiami zorientowanymi na ciało, takimi jak EMDR czy techniki opukiwania, dostarczają przesłanek, że właśnie tak może być. Jako przykład chciałabym tutaj przywołać badania prowadzone z udziałem weteranów wojennych. Ta grupa pacjentów uznawana jest za jedną z najtrudniejszych w leczeniu PTSD — co potwierdza m.in. metaanaliza Bradleya z 2005 roku, oceniająca skuteczność terapii poznawczo-behawioralnej (Bradley i in., 2005).
Również nowsze badania pokazują tylko ograniczoną skuteczność terapii poznawczo-behawioralnych jak Cognitive Processing lub przedłużona ekspozycja: w jednym z badań z 2022 roku 55% pacjentów przerwało przedłużoną ekspozycję, tylko 40% nie spełniało już po terapii kryteriów PTSD. W terapii Cognitive Processing 46% przerwało terapię, 28% nie spełniało po niej diagnozy PTSD (Schnurr et al., 2022). Wysokie wskaźniki rezygnacji wskazują na to, że weterani doświadczają konfrontacji po prostu jako zbyt obciążającej.
Badania nad terapiami pracy z ciałem w traumie jak EMDR lub techniki opukiwania jak EFT, które stosują bodziec somatyczny podczas interwencji, dają natomiast wskazówki, że weterani doświadczają ich jako mniej obciążających.
Szczególnie imponujące jest badanie z 2018 roku, w którym weterani otrzymali 20 sesji EMDR. W badaniu tym uwzględniono tylko tych weteranów, u których inne terapie wcześniej zawiodły. Autorzy piszą: „Chociaż większość przyznała, że byli sceptyczni, czy dodatkowe leczenie zadziała, wszyscy byli gotowi spróbować kolejnego, ponieważ nie chcieli dalej żyć z objawami PTSD. Reakcje na wcześniejsze terapie wahały się od współpracy po weteranów, którzy po sesjach byli tak poruszeni, że „wyszli i się upili“, co pogłębiło ich uzależnienie od alkoholu. Inni weterani zgłaszali, że przerywali terapię przedwcześnie, by uniknąć intensywności [konfrontacji]. Niektórzy żołnierze zgłaszali, że zakończyli leczenie innymi terapiami 2–4 lata wcześniej z rozczarowującymi rezultatami.“ (Hurley, 2018, S.1, tłum. A.P.) To badanie, jak również badanie z techniką opukiwania EFT, wykazało znacznie niższe wskaźniki rezygnacji (4%) i wskaźniki skuteczności 100% i 86% (Church et al., 2013; Hurley, 2018).
Te badania można potraktować jako pierwsze wskazówki, że „sygnały bezpieczeństwa“ (Porges, 2022) w ustawieniu terapeutycznym mogą rzeczywiście uczynić terapię traumy bezpieczniejszą i skuteczniejszą!
Są one zaproszeniem, aby Teorię Poliwagalną dopracować i poprzez ukierunkowane badania naprawdę głębiej zrozumieć, zamiast ją odrzucać.
Dr med. Antonia Pfeiffer
PS: Gdy w tym rozdziale, jak również w mojej książce, ze względów czytelności używana jest gramatycznie męska forma, to włącza ona kobiety, mężczyzn i osoby niebinarne.
Źródła:
Aaronson, S. T., Sears, P., Ruvuna, F., Bunker, M., Conway, C. R., Dougherty, D. D., Reimherr, F. W., Schwartz, T. L., & Zajecka, J. M. (2017). A 5-Year Observational Study of Patients With Treatment-Resistant Depression Treated With Vagus Nerve Stimulation or Treatment as Usual: Comparison of Response, Remission, and Suicidality. American Journal of Psychiatry, 174(7), 640–648. https://doi.org/10.1176/appi.ajp.2017.16010034
Adam, J., Rupprecht, S., Künstler, E. C. S., & Hoyer, D. (2023). Heart rate variability as a marker and predictor of inflammation, nosocomial infection, and sepsis – A systematic review. Autonomic Neuroscience, 249, 103116. https://doi.org/10.1016/j.autneu.2023.103116
Alboni, P., & Alboni, M. (2017). Typical vasovagal syncope as a “defense mechanism” for the heart by contrasting sympathetic overactivity. Clinical Autonomic Research, 27(4), 253–261. https://doi.org/10.1007/s10286-017-0446-2
Alboni, P., Alboni, M., & Gianfranchi, L. (2011). Simultaneous occurrence of two independent vagal reflexes: A possible cause of vagal sudden death. Heart, 97(8), 623–625. https://doi.org/10.1136/hrt.2010.221416
Aranow, C., Atish-Fregoso, Y., Lesser, M., Mackay, M., Anderson, E., Chavan, S., Zanos, T. P., Datta-Chaudhuri, T., Bouton, C., Tracey, K. J., & Diamond, B. (2021). Transcutaneous auricular vagus nerve stimulation reduces pain and fatigue in patients with systemic lupus erythematosus: A randomised, double-blind, sham-controlled pilot trial. Annals of the Rheumatic Diseases, 80(2), 203–208. https://doi.org/10.1136/annrheumdis-2020-217872
Baldy, C., Chamberland, S., Fournier, S., & Kinkead, R. (2017). Sex-Specific Consequences of Neonatal Stress on Cardio-Respiratory Inhibition Following Laryngeal Stimulation in Rat Pups. Eneuro, 4(6), ENEURO.0393-17.2017. https://doi.org/10.1523/ENEURO.0393-17.2017
Bauer, S., Baier, H., Baumgartner, C., Bohlmann, K., Fauser, S., Graf, W., Hillenbrand, B., Hirsch, M., Last, C., Lerche, H., Mayer, T., Schulze-Bonhage, A., Steinhoff, B. J., Weber, Y., Hartlep, A., Rosenow, F., & Hamer, H. M. (2016). Transcutaneous Vagus Nerve Stimulation (tVNS) for Treatment of Drug-Resistant Epilepsy: A Randomized, Double-Blind Clinical Trial (cMPsE02). Brain Stimulation, 9(3), 356–363. https://doi.org/10.1016/j.brs.2015.11.003
Becker, L. E., Zhang, W., & Pereyra, P. M. (1993). Delayed maturation of the vagus nerve in sudden infant death syndrome. Acta Neuropathologica, 86(6), 617–622. https://doi.org/10.1007/BF00294301
Bejjani, C., Machaalani, R., & Waters, K. A. (2013). The dorsal motor nucleus of the vagus (DMNV) in sudden infant death syndrome (SIDS): Pathways leading to apoptosis. Respiratory Physiology & Neurobiology, 185(2), 203–210. https://doi.org/10.1016/j.resp.2012.09.001
Bradley, R., Greene, J., Russ, E., Dutra, L., & Westen, D. (2005). A Multidimensional Meta-Analysis of Psychotherapy for PTSD. American Journal of Psychiatry, 162(2), 214–227. https://doi.org/10.1176/appi.ajp.162.2.214
Brämer, D., Günther, A., Rupprecht, S., Nowack, S., Adam, J., Meyer, F., Schwab, M., Surber, R., Witte, O. W., Hoyer, H., & Hoyer, D. (2019). Very Low Frequency Heart Rate Variability Predicts the Development of Post-Stroke Infections. Translational Stroke Research, 10(6), 607–619. https://doi.org/10.1007/s12975-018-0684-1
Bremner, J. D., Gurel, N. Z., Jiao, Y., Wittbrodt, M. T., Levantsevych, O. M., Huang, M., Jung, H., Shandhi, M. H., Beckwith, J., Herring, I., Rapaport, M. H., Murrah, N., Driggers, E., Ko, Y.-A., Alkhalaf, M. L., Soudan, M., Song, J., Ku, B. S., Shallenberger, L., … Pearce, B. D. (2020). Transcutaneous vagal nerve stimulation blocks stress-induced activation of Interleukin-6 and interferon-γ in posttraumatic stress disorder: A double-blind, randomized, sham-controlled trial. Brain, Behavior, & Immunity – Health, 9, 100138. https://doi.org/10.1016/j.bbih.2020.100138
Cerritelli, F., Frasch, M. G., Antonelli, M. C., Viglione, C., Vecchi, S., Chiera, M., & Manzotti, A. (2021). A Review on the Vagus Nerve and Autonomic Nervous System During Fetal Development: Searching for Critical Windows. Frontiers in Neuroscience, 15, 721605. https://doi.org/10.3389/fnins.2021.721605
Cheng, G., Zhu, H., Zhou, X., Qu, J., Ashwell, K. W. S., & Paxinos, G. (2008). Development of the human dorsal nucleus of the vagus. Early Human Development, 84(1), 15–27. https://doi.org/10.1016/j.earlhumdev.2007.01.012
Church, D., Hawk, C., Brooks, A. J., Toukolehto, O., Wren, M., Dinter, I., & Stein, P. (2013). Psychological Trauma Symptom Improvement in Veterans Using Emotional Freedom Techniques: A Randomized Controlled Trial. Journal of Nervous & Mental Disease, 201(2), 153–160. https://doi.org/10.1097/NMD.0b013e31827f6351
Croy, I., Fairhurst, M. T., & McGlone, F. (2022). The role of C-tactile nerve fibers in human social development. Current Opinion in Behavioral Sciences, 43, 20–26. https://doi.org/10.1016/j.cobeha.2021.06.010
Ding, J., Wu, Y., Wang, B., & Sun, Z. (2024). The relationship between depression severity and heart rate variability in children and adolescents: A meta-analysis. Journal of Psychosomatic Research, 182, 111804. https://doi.org/10.1016/j.jpsychores.2024.111804
Doody, S., J., Dinets, V., & Burghardt, G.M. (2021). The secret social life of reptiles. Johns Hopkins University Press.
Elliott, R. E., Morsi, A., Kalhorn, S. P., Marcus, J., Sellin, J., Kang, M., Silverberg, A., Rivera, E., Geller, E., Carlson, C., Devinsky, O., & Doyle, W. K. (2011). Vagus nerve stimulation in 436 consecutive patients with treatment-resistant epilepsy: Long-term outcomes and predictors of response. Epilepsy & Behavior, 20(1), 57–63. https://doi.org/10.1016/j.yebeh.2010.10.017
Elliott, R. E., Morsi, A., Tanweer, O., Grobelny, B., Geller, E., Carlson, C., Devinsky, O., & Doyle, W. K. (2011). Efficacy of vagus nerve stimulation over time: Review of 65 consecutive patients with treatment-resistant epilepsy treated with VNS >10years. Epilepsy & Behavior, 20(3), 478–483. https://doi.org/10.1016/j.yebeh.2010.12.042
Englot, D. J., Hassnain, K. H., Rolston, J. D., Harward, S. C., Sinha, S. R., & Haglund, M. M. (2017). Quality-of-life metrics with vagus nerve stimulation for epilepsy from provider survey data. Epilepsy & Behavior, 66, 4–9. https://doi.org/10.1016/j.yebeh.2016.10.005
Ford, T. W., & McWilliam, P. N. (1986). The effects of electrical stimulation of myelinated and non‐myelinated vagal fibres on heart rate in the rabbit. The Journal of Physiology, 380(1), 341–347. https://doi.org/10.1113/jphysiol.1986.sp016289
Garcia Perez, M., & Jordan, D. (2001). Effect of stimulating non-myelinated vagal axons on atrio-ventricular conduction and left ventricular function in anaesthetized rabbits. Autonomic Neuroscience, 86(3), 183–191. https://doi.org/10.1016/S1566-0702(00)00252-6
Gazi, A. H., Harrison, A. B., Lambert, T. P., Obideen, M., Alavi, P., Murrah, N., Shallenberger, L., Driggers, E. G., Ortega, R. A., Washington, B. P., Walton, K. M., Welsh, J. W., Vaccarino, V., Shah, A. J., Tang, Y.-L., Gupta, R., Back, S. E., Inan, O. T., & Bremner, J. D. (2022). Transcutaneous cervical vagus nerve stimulation reduces behavioral and physiological manifestations of withdrawal in patients with opioid use disorder: A double-blind, randomized, sham-controlled pilot study. Brain Stimulation, 15(5), 1206–1214. https://doi.org/10.1016/j.brs.2022.08.017
Google scholar. (2024). [Post]. Porges, Steven. https://scholar.google.com/scholar?hl=de&as_sdt=0%2C5&q=stephen+Porges&btnG=
Grossman, P. (2023). Fundamental challenges and likely refutations of the five basic premises of the polyvagal theory. Biological Psychology, 180, 108589. https://doi.org/10.1016/j.biopsycho.2023.108589
Gurel, N. Z., Wittbrodt, M. T., Jung, H., Shandhi, Md. M. H., Driggers, E. G., Ladd, S. L., Huang, M., Ko, Y.-A., Shallenberger, L., Beckwith, J., Nye, J. A., Pearce, B. D., Vaccarino, V., Shah, A. J., Inan, O. T., & Bremner, J. D. (2020). Transcutaneous cervical vagal nerve stimulation reduces sympathetic responses to stress in posttraumatic stress disorder: A double-blind, randomized, sham controlled trial. Neurobiology of Stress, 13, 100264. https://doi.org/10.1016/j.ynstr.2020.100264
Higa, K. T., Mori, E., Viana, F. F., Morris, M., & Michelini, L. C. (2002). Baroreflex control of heart rate by oxytocin in the solitary-vagal complex. American Journal of Physiology-Regulatory, Integrative and Comparative Physiology, 282(2), R537–R545. https://doi.org/10.1152/ajpregu.00806.2000
Hurley, E. C. (2018). Effective Treatment of Veterans With PTSD: Comparison Between Intensive Daily and Weekly EMDR Approaches. Frontiers in Psychology, 9, 1458. https://doi.org/10.3389/fpsyg.2018.01458
Immanuel, S., Teferra, M. N., Baumert, M., & Bidargaddi, N. (2023). Heart Rate Variability for Evaluating Psychological Stress Changes in Healthy Adults: A Scoping Review. Neuropsychobiology, 82(4), 187–202. https://doi.org/10.1159/000530376
Kong, E., Monje, F. J., Hirsch, J., & Pollak, D. D. (2014). Learning not to Fear: Neural Correlates of Learned Safety. Neuropsychopharmacology, 39(3), 515–527. https://doi.org/10.1038/npp.2013.191
Koopman, F. A., Chavan, S. S., Miljko, S., Grazio, S., Sokolovic, S., Schuurman, P. R., Mehta, A. D., Levine, Y. A., Faltys, M., Zitnik, R., Tracey, K. J., & Tak, P. P. (2016). Vagus nerve stimulation inhibits cytokine production and attenuates disease severity in rheumatoid arthritis. Proceedings of the National Academy of Sciences, 113(29), 8284–8289. https://doi.org/10.1073/pnas.1605635113
Li, Y., Wang, J., Li, X., Jing, W., Omorodion, I., & Liu, L. (2021). Association Between Heart Rate Variability and Parkinson’s Disease: A Meta-analysis. Current Pharmaceutical Design, 27(17), 2056–2067. https://doi.org/10.2174/1871527319666200905122222
Liem, Thorsten, & Neuhuber, Winfried, W. L. (2021, April 16). Kritik an der Polyvagaltheorie. https://osteopathie-liem.de/kritik-an-der-polyvagaltheorie/
Lin, H., Yen, C., Chen, W., Hsu, C., Kung, Y., Wu, J., Su, Y., Chen, K., Chen, H., Lien, C., Wang, M., & Chang, C. (2024). Unveiling the age‐related dynamics in Sjögren’s syndrome: Insights from heart rate variability and autonomic function. International Journal of Rheumatic Diseases, 27(3), e15088. https://doi.org/10.1111/1756-185X.15088
Lotufo, P. A., Valiengo, L., Benseñor, I. M., & Brunoni, A. R. (2012). A systematic review and meta‐analysis of heart rate variability in epilepsy and antiepileptic drugs. Epilepsia, 53(2), 272–282. https://doi.org/10.1111/j.1528-1167.2011.03361.x
Magalhães, D. M., Mampay, M., Sebastião, A. M., Sheridan, G. K., & Valente, C. A. (2024). Age-related impact of social isolation in mice: Young vs middle-aged. Neurochemistry International, 174, 105678. https://doi.org/10.1016/j.neuint.2024.105678
Neuhuber, W. L., & Berthoud, H.-R. (2022). Functional anatomy of the vagus system: How does the polyvagal theory comply? Biological Psychology, 174, 108425. https://doi.org/10.1016/j.biopsycho.2022.108425
Noble, L. J., Gonzalez, I. J., Meruva, V. B., Callahan, K. A., Belfort, B. D., Ramanathan, K. R., Meyers, E., Kilgard, M. P., Rennaker, R. L., & McIntyre, C. K. (2017). Effects of vagus nerve stimulation on extinction of conditioned fear and post-traumatic stress disorder symptoms in rats. Translational Psychiatry, 7(8), e1217. https://doi.org/10.1038/tp.2017.191
Peña, D. F., Childs, J. E., Willett, S., Vital, A., McIntyre, C. K., & Kroener, S. (2014). Vagus nerve stimulation enhances extinction of conditioned fear and modulates plasticity in the pathway from the ventromedial prefrontal cortex to the amygdala. Frontiers in Behavioral Neuroscience, 8. https://doi.org/10.3389/fnbeh.2014.00327
Peña, D. F., Engineer, N. D., & McIntyre, C. K. (2013). Rapid remission of conditioned fear expression with extinction training paired with vagus nerve stimulation. Biological Psychiatry, 73(11), 1071–1077. https://doi.org/10.1016/j.biopsych.2012.10.021
Pereyra, P. M., Zhang, W., Schmidt, M., & Becker, L. E. (1992). Development of myelinated and unmyelinated fibers of human vagus nerve during the first year of life. Journal of the Neurological Sciences, 110(1–2), 107–113. https://doi.org/10.1016/0022-510X(92)90016-E
Pfeiffer, A. (2023). Emotionale Erinnerung! Klopfen als Schlüssel für Lösungen neurowissenschaftliche WIrkhypothesen der Klopftechniken (2. Aufl.). Carl-Auer-Systeme Verlag und Verlagsbuchhandlung GmbH.
Pittig, A., Kotter, R., & Hoyer, J. (2019). The Struggle of Behavioral Therapists With Exposure: Self-Reported Practicability, Negative Beliefs, and Therapist Distress About Exposure-Based Interventions. Behavior Therapy, 50(2), 353–366. https://doi.org/10.1016/j.beth.2018.07.003
Pittig, A., Van Den Berg, L., & Vervliet, B. (2016). The key role of extinction learning in anxiety disorders: Behavioral strategies to enhance exposure-based treatments. Current Opinion in Psychiatry, 29(1), 39–47. https://doi.org/10.1097/YCO.0000000000000220
Polyvagal-Theorie. (2024, Juni 7). [Wikipedia]. Wikipedia. https://de.wikipedia.org/wiki/Polyvagal-Theorie
Porges, S. W. (1995). Orienting in a defensive world: Mammalian modifications of our evolutionary heritage. A Polyvagal Theory. Psychophysiology, 32(4), 301–318. https://doi.org/10.1111/j.1469-8986.1995.tb01213.x
Porges, S. W. (2022). Polyvagal Theory: A Science of Safety. Frontiers in Integrative Neuroscience, 16, 871227. https://doi.org/10.3389/fnint.2022.871227
Porges, S. W. (2023). The vagal paradox: A polyvagal solution. Comprehensive Psychoneuroendocrinology, 16, 100200. https://doi.org/10.1016/j.cpnec.2023.100200
Riley, J. L., Noble, D. W. A., Byrne, R. W., & Whiting, M. J. (2017). Early social environment influences the behaviour of a family-living lizard. Royal Society Open Science, 4(5), 161082. https://doi.org/10.1098/rsos.161082
Roelofs, K. (2017). Freeze for action: Neurobiological mechanisms in animal and human freezing. Philosophical Transactions of the Royal Society B: Biological Sciences, 372(1718), 20160206. https://doi.org/10.1098/rstb.2016.0206
Rogers, R. C., & Hermann, G. E. (1985). Dorsal medullary oxytocin, vasopressin, oxytocin antagonist, and TRH effects on gastric acid secretion and heart rate. Peptides, 6(6), 1143–1148. https://doi.org/10.1016/0196-9781(85)90441-3
Schnurr, P. P., Chard, K. M., Ruzek, J. I., Chow, B. K., Resick, P. A., Foa, E. B., Marx, B. P., Friedman, M. J., Bovin, M. J., Caudle, K. L., Castillo, D., Curry, K. T., Hollifield, M., Huang, G. D., Chee, C. L., Astin, M. C., Dickstein, B., Renner, K., Clancy, C. P., … Shih, M.-C. (2022). Comparison of Prolonged Exposure vs Cognitive Processing Therapy for Treatment of Posttraumatic Stress Disorder Among US Veterans: A Randomized Clinical Trial. JAMA Network Open, 5(1), e2136921. https://doi.org/10.1001/jamanetworkopen.2021.36921
Sinniger, V., Pellissier, S., Fauvelle, F., Trocmé, C., Hoffmann, D., Vercueil, L., Cracowski, J., David, O., & Bonaz, B. (2020). A 12‐month pilot study outcomes of vagus nerve stimulation in Crohn’s disease. Neurogastroenterology & Motility, 32(10), e13911. https://doi.org/10.1111/nmo.13911
Sohn, R., Assar, T., Kaufhold, I., Brenneis, M., Braun, S., Junker, M., Zaucke, F., Pongratz, G., & Jenei-Lanzl, Z. (2024). Osteoarthritis patients exhibit an autonomic dysfunction with indirect sympathetic dominance. Journal of Translational Medicine, 22(1), 467. https://doi.org/10.1186/s12967-024-05258-9
Souza, R. R., Oleksiak, C. R., Tabet, M. N., Rennaker, R. L., Hays, S. A., Kilgard, M. P., & McIntyre, C. K. (2021). Vagus nerve stimulation promotes extinction generalization across sensory modalities. Neurobiology of Learning and Memory, 181, 107425. https://doi.org/10.1016/j.nlm.2021.107425
Strain, M. M., Conley, N. J., Kauffman, L. S., Espinoza, L., Fedorchak, S., Martinez, P. C., Crook, M. E., Jalil, M., Hodes, G. E., Abbott, S. B. G., Güler, A. D., Campbell, J. N., & Boychuk, C. R. (2024). Dorsal motor vagal neurons can elicit bradycardia and reduce anxiety-like behavior. iScience, 27(3), 109137. https://doi.org/10.1016/j.isci.2024.109137
Szeska, C., Pünjer, H., Riemann, S., Meinzer, M., & Hamm, A. O. (2022). Stimulation of the ventromedial prefrontal cortex blocks the return of subcortically mediated fear responses. Translational Psychiatry, 12(1), 394. https://doi.org/10.1038/s41398-022-02174-8
Szeska, C., Richter, J., Wendt, J., Weymar, M., & Hamm, A. O. (2020). Promoting long-term inhibition of human fear responses by non-invasive transcutaneous vagus nerve stimulation during extinction training. Scientific Reports, 10(1), 1529. https://doi.org/10.1038/s41598-020-58412-w
Taylor, E. W., Wang, T., & Leite, C. A. C. (2022). An overview of the phylogeny of cardiorespiratory control in vertebrates with some reflections on the ‘Polyvagal Theory’. Biological Psychology, 172, 108382. https://doi.org/10.1016/j.biopsycho.2022.108382
Veerakumar, A., Yung, A. R., Liu, Y., & Krasnow, M. A. (2022). Molecularly defined circuits for cardiovascular and cardiopulmonary control. Nature, 606(7915), 739–746. https://doi.org/10.1038/s41586-022-04760-8
Visted, E., Sørensen, L., Osnes, B., Svendsen, J. L., Binder, P.-E., & Schanche, E. (2017). The Association between Self-Reported Difficulties in Emotion Regulation and Heart Rate Variability: The Salient Role of Not Accepting Negative Emotions. Frontiers in Psychology, 8. https://doi.org/10.3389/fpsyg.2017.00328
Walz, D., & Grossman, P. (2024). »Polyvagal«: Die schöne Theorie und die hässlichen Fakten: Warum die Erzählung der Polyvagal-Theorie zwar verlockend, aber wahrscheinlich falsch ist. Psychotherapie, 29(2), 163–174. https://doi.org/10.30820/2364-1517-2024-2-163
Wittbrodt, M. T., Gurel, N. Z., Nye, J. A., Ladd, S., Shandhi, M. M. H., Huang, M., Shah, A. J., Pearce, B. D., Alam, Z. S., Rapaport, M. H., Murrah, N., Ko, Y.-A., Haffer, A. A., Shallenberger, L. H., Vaccarino, V., Inan, O. T., & Bremner, J. D. (2020). Non-invasive vagal nerve stimulation decreases brain activity during trauma scripts. Brain Stimulation, 13(5), 1333–1348. https://doi.org/10.1016/j.brs.2020.07.002
Woolley, D. C., McWilliam, P. N., Ford, T. W., & Clarke, R. W. (1987). The effect of selective electrical stimulation of non-myelinated vagal fibres on heart rate in the rabbit. Journal of the Autonomic Nervous System, 21(2–3), 215–221. https://doi.org/10.1016/0165-1838(87)90024-5
Wu, L.-L., Bo, J.-H., Zheng, F., Zhang, F., Chen, Q., Li, Y.-H., Kang, Y.-M., & Zhu, G.-Q. (2021). Salusin-β in Intermediate Dorsal Motor Nucleus of the Vagus Regulates Sympathetic-Parasympathetic Balance and Blood Pressure. Biomedicines, 9(9), 1118. https://doi.org/10.3390/biomedicines9091118
